G* = = OPERADOR QUÂNTICO DE GRACELI.
EQUAÇÃO DE GRACELI.. PARA INTERAÇÕES DE ONDAS E INTERAÇÕES DAS FORÇAS FUNDAMENTAIS
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
{ -1 / G* = / T] / c} =
G* = = OPERADOR DE GRACELI = Em mecânica quântica, o OPERADOR DE GRACELI [ G* =] é um operador cujo observável corresponde à ENERGIA TOTAL DO SISTEMA , TODAS AS INTERAÇÕES INCLUINDO TODAS AS INTERAÇÕES DAS FORÇAS FUNDAMENTAIS [AS QUATRO FORÇAS] [ELETROMAGNÉTICA, FORTE, FRACA E GRAVITACIONAL], INTERAÇÕES SPINS-ÓRBITAS, ESTRUTURRA ELETRÔNICA DOS ELEMENTOS QUÍMICOS, TRANSFORMAÇÕES, SISTEMAS DE ONDAS QUÂNTICAS, MOMENTUM MAGNÉTICO de cada elemento químico e partícula, NÍVEIS DE ENERGIA , número quântico , e o sistema GENERALIZADO GRACELI.
COMO TAMBÉM ESTÁ RELACIONADO A TODO SISTEMA CATEGORIAL GRACELI, TENSORIAL GRACELI DIMENSIONAL DE GRACELI..
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
A Lei de Moseley é uma lei empírica obtida pela relação entre raios-X característicos dos átomos. É importante historicamente na justificação do modelo nuclear para o átomo, em que toda a carga positiva está contida no núcleo do átomo, e é associada ao seu número de elétrons. Na época de Moseley, o número atômico era apenas a posição do elemento na tabela periódica, sem significado físico.[1]
História[editar | editar código-fonte]
Nas conversas com Niels Bohr em 1913, Moseley ficou interessado no modelo atômico de Bohr, em que o espectro de emissão eletromagnética dos átomos é proporcional à raiz quadrada de Z, ou seja, à carga elétrica no núcleo (que tinha sido descoberta dois anos antes). O modelo de Bohr tinha sido bem sucedido em demonstrar a fórmula empírica de Rydberg para o átomo de Hidrogênio, porém não conseguia explicar o espectro para os elementos mais massivos. Em particular, apenas dois anos antes, Rutherford em 1911, postulou que o Z para átomos de prata menos que a metade de sua massa e pouco tempo depois, Antonius van den Broek sugeriu que o valor de Z não era a metade da massa atômica, mas era exatamente o número atômico, ou a posição na tabela periódica. Até aquela época, não se conhecia qualquer significado físico para a posição do elemento na tabela periódica, com exceção da ordenação de algumas propriedades químicas.
Na maioria dos casos, a tabela periódica tende a ficar de acordo com a massa atômica, porém existem alguns casos famosos de átomos com número atômico maior e massa menos, como por exemplo o cobalto com massa 58,9 e Z=27 e o níquel de massa 58,7 e Z=28.
Como o espectro de emissão para átomos com Z altos estão na faixa dos raios-X moles (facilmente absorvidos pelo ar), Moseley precisou utilizar tubos de vácuo. Usando as técnicas de difração de raios-X, Moseley descobriu que as linhas de emissões mais intensas dos átomos eram intrinsecamente relacionadas com o número atômico Z.
Essa linha atualmente é conhecida como linha K-alfa. E finalmente Moseley descobriu que essa relação podia ser descrita por uma fórmula simples, que ficou conhecida como a Lei de Moseley.
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Onde:
- é a frequencia de emissão da linha Kα
- and são constantes que dependem do tipo de linha
Por exemplo, os valores de e são os mesmos para todas as linhas então a fórmula pode ser simplificada para:
- Hz
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Moseley escolheu mostrar a fórmula sem mais com um número constante puro, no estilo de Johannes Rydberg, deixando a constante como 3/4 (ou 1- 1/4) da frequência fundamental de Rydberg ((3.29*1015 Hz) para as linhas e novamente para as linhas , ficou igual a 1/4 - 1/9 = 5/36 vezes a frequência de Rydberg, essa foi a forma que Moseley escolheu para escrever sua fórmula.[2]
A constante empírica é dado pelo fit dos dados das linhas de emissão e Moseley obteve o valor (Z - 7.4)² para as linhas e igual a 1 para as linhas .
Abaixo está a formulação original de Moseley (com os dois lados elevado ao quadrado para melhor clareza).
- Hz
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
- Hz
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Derivação e justificativo do modelo de Bohr do núcleo atômico de Rutheford[editar | editar código-fonte]
Moseley deduziu sua fórmula empiricamente plotando a raiz quadrada das frequências de emissão de raios-x em função do número atômico, entretanto, sua dedução podia ser explicada em termos do modelo de Bohr (veja detalhes para a derivação para o átomo de Hidrogênio), se certos pressupostos razoáveis sobre a estrutura atômica dos outros elementos forem feitos, porém na época em que Moseley derivou sua lei, nem ele e nem Bohr conseguiu explicar a sua forma.
A fórmula empírica de Rydberg é explicada pelo modelo de Bohr através da descrição de transições ou saltos quânticos entre um nível de energia a outro no átomo de Hidrogênio. Quando um elétron salta de um nível energético para outro, um fóton é emitido. Usando a fórmula para diferentes níveis de energia, é possível determinar as energias, ou frequências que um átomo de Hidrogênio pode emitir.
A energia do fóton que um átomo de hidrogênio emite no modelo de Bohr, é dado pela diferença de energia entre dois níveis.
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
(note que Bohr usou unidades de Planck em que ), e
= massa do elétron
= carga do elétron (1.602 × 10−19 coulombs)
= número quântico do nível final de energia
= número quântico do nível inicial de energia
Assume-se que o nível de energia final é menor do que o nível inicial.
Por exemplo, para o hidrogênio, a fórmula fica por que o Z (a carga elétrica positiva no núcleo) é igual a 1, com isso, o núcleo de hidrogênio contém uma única carga. Assim, para o átomo de hidrogênio (onde o elétron pode ser descrito como uma nuvem esférica entorno do núcleo) Bohr percebeu que era necessário acrescentar uma quantidade adicional ao termo convencional a fim de explicar a atração extra sobre o elétron, e portanto a energia extra entre os níveis quânticos.
Isso foi feito em 1914 quando Bohr conseguiu adaptar a fórmula de Moseley, através de duas definições. A primeira é de que o elétron responsável pela linha espectral mais brilhante (Kα), que Moseley tinha estudado para diversos elementos, era resultado da transição de um único elétron entre as camadas K e L do átomo (i.e., da camada mais próxima do núcleo para a segunda mais próxima), com números de energia quântica de 1 e 2. Finalmente, o Z, embora ainda na raiz quadrada, requer que seja subtraído 1 para calcular o Kα (Após a morte de Moseley, isso foi entendido como uma correção da conta devido a carga total do núcleo, menos um elétron que remanesceu na camada K, visto simplesmente como elétron 1s). Em todo caso, o termo (Z-1) requer que esteja em uma raiz quadrada para se ajustar aos dados empíricos, então a conta de Bohr para a fórmula de Moseley para a linha Kα fica:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
ou dividindo ambos os lados por h para converter E para f):
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Agrupando todos os termos constantes da fórmula em uma única, resulta em um termo de frequência equivalente a 3/4 da energia de ionização de 13,6 eV (veja constante de Rydberg para hidrogênio = 3.29 x 1015 Hz), como o valor final de 2.47 x 1015 Hz, uma boa aproximação com o valor obtido empiricamente por Moseley de 2.48 x 1015 Hz. Essa frequência fundamental é igual a linha alfa da série de Lyman para o hidrogênio, porque a transição 1s para 2p é responsável pela linha alfa de Lyman no hidrogênio e para as linhas Kα do espectro de raios-X para elementos acima do hidrogênio, Moseley tinha plena consciência de que sua frequência fundamental era a linha alfa de Lyman, que a frequência fundamental de Rydberg resultava de duas energias atômicas fundamentais, e por isso que a diferença do fator de Rydberg-Bohr era de exatamente 3/4.
Entretanto a necessidade da redução de Z por um número muito próximo de 1 para as linhas Kα dos elementos pesados, (acima do Alumínio) foi deduzida de forma totalmente empírica por Moseley, e não foi discutida de forma teórica em seus artigos, pois o conceito de camadas atômicas com pares de elétron ainda não tinha sido muito bem estabelecida em 1913 ( O assunto só ficaria mais claro por volta de 1920), e em particular o modelo de Schrödinger para as órbitas atômicas ainda não tinha sido formalmente introduzido, e ainda não foi totalmente entendido até antes de 1926.
Até o momento, Moseley foi enigmático com Bohr sobre o termo Z-1, Bohr pensava que a camada interna dos elétrons podia conter de 4 a 6 elétrons. Moseley por um tempo pensou que as linhas K eram resultados a transição simultânea de 4 elétrons da camada L para K, porém ele não se comprometeu a ponto de publicas essas ideias.
No que se refere as transições Lα, na visão moderna, associamos cada camada eletrônica com um número quântico n, onde cada camada contém 2n² elétrons, ou seja, se n=1, temos no máximo 2 elétrons, se n=2, 8 elétrons. O valor empírico de 7,4 obtido por Moseley para é associado a transição de n=2 para 3, e é chamada de transição Lα (não confundir com transição alfa de Lyman), e ocorre da camada M para L na notação de letras de Bohr. O valor de 7,4 é agora conhecido como um efeito de blindagem eletrônica do elétrons contidos nas camadas
A Lei de Planck para radiação de corpo negro exprime a radiância espectral em função do comprimento de onda e da temperatura do corpo negro.
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
A tabela seguinte descreve as variáveis e unidades utilizadas:
Um sistema de mecânica quântica é um sistema no qual o comportamento de suas partículas pode ser explicado através da matemática incorporando a quatro princípios:
- A quantização da energia; onde a troca de energia ocorre em pacotes de energia discreta e a transferência não é contínua, como descrito por Max Planck.
- A dualidade matéria-energia, que primeiro foi considerada por James Maxwell que a luz é uma onda eletromagnética e, descoberto por Einstein, a natureza da partícula da luz. Doravante, a luz é considerada como tendo natureza dual.
- O princípio da incerteza que estabelece um limite na precisão com que certos pares de propriedades de uma dada partícula física. Como Werner Heisenberg afirmou, em escalas microscópicas, a natureza em si não permite as medidas de posição e momento das partículas simultaneamente.
- Finalmente, o princípio da correspondência onde todas as grandezas do do mundo quântico (usualmente microscópico) tem sua correspondência no mundo clássico. Como colocado por Niels Bohr: A física clássica e física quântica dão as mesmas respostas quando o sistema se torna grande[1].
Definição matemática[editar | editar código-fonte]
Muito da compreensão da mecânica quântica pode ser obtida a partir da compreensão das soluções de forma fechada para a equação de Schrödinger não relativista dependente do tempo em um espaço de configuração apropriada. Em coordenadas cartesianas vetoriais , a equação assume a forma:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
em que é a função de onda do sistema, H é o operador hamiltoniano e T e V são os operadores da energia cinética e energia potencial, respectivamente. (Formas comuns desses operadores aparecem nos colchetes.) A quantidade t é o tempo. Os estados estacionários dessa equação são encontrados resolvendo-se a função de autovalores e autovetores (independente do tempo) da equação de Schrödinger,
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
ou qualquer formulação equivalente desta equação em um sistema de coordenadas diferente das coordenadas cartesianas. Por exemplo, sistemas com simetria esférica são simplificados quando expressos com coordenadas esféricas. Muitas vezes, apenas soluções numéricas para a equação de Schrödinger podem ser encontradas para um determinado sistema físico e sua energia potencial associada. Existe um subconjunto de sistemas físicos para os quais a forma das funções de autofunções e suas energias associadas podem ser encontradas.
Em física e engenharia elétrica, o coeficiente de reflexão é um parâmetro que descreve quanto de uma onda eletromagnética é refletida por uma descontinuidade de impedância no meio de transmissão. É igual à razão entre a amplitude da onda refletida e a onda incidente, sendo cada uma expressa como fasores. Albedo, a refletividade difusa, e a refletância de um sistema também são chamadas de "coeficiente de reflexão".
Definições[editar | editar código-fonte]
Diferentes especialidades têm diferentes aplicações para o termo.
Acústica[editar | editar código-fonte]
Especialistas em acústica usam coeficientes de reflexão para entender o efeito de diferentes materiais em seus ambientes acústicos.
Circulação do sangue[editar | editar código-fonte]
Em circulação capilar, de acordo com a equação de Starling
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
, simplificada para o capilar sanguíneo, o movimento de um fluido, neste caso o sangue, depende assim de 5 variáveis:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde o "coeficiente de reflexão" ( R ) é a variável que exprime a impermeabilidade da parede às proteinas é, em condiçóes normais, igual a 1. A parede capilar não deixa passar proteinas. O coeficiente só será considerado em casos patológicos com aumento da permeabilidade às proteinas e R <1[1].
Um problema importante na mecânica quântica é o de uma partícula num potencial esfericamente simétrico, isto é, um potencial que depende apenas da distância entre a partícula e um ponto central definido. Em particular, se a partícula em questão é um elétron e o potencial é derivado da lei de Coulomb, então o problema pode ser usado para descrever um átomo de hidrogênio (um elétron ou íon).
No caso geral, a dinâmica de uma partícula em um potencial esfericamente simétrico é governada por um hamiltoniano da seguinte forma:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde é a massa da partícula, é o operador momentum, e o potencial depende apenas de , o módulo do vetor raio; r. As funções e energias da onda quântica (autovalores) são encontradas resolvendo a equação de Schrödinger com este hamiltoniano. Devido à simetria esférica do sistema, é natural usar coordenadas esféricas , e . Quando isso é feito, a equação de Schrödinger independente do tempo para o sistema é separável, permitindo que os problemas angulares sejam tratados facilmente, e deixando uma equação diferencial ordinária em para determinar as energias para o potencial particular em discussão.
O oscilador harmônico quântico é o análogo mecânico quântico do oscilador harmônico clássico. É um dos sistemas modelo mais importante em mecânica quântica, já que qualquer potencial pode ser aproximado por um potencial harmônico nas proximidades do ponto de equilíbrio estável (mínimo). Além disso, é um dos sistemas mecânico quânticos que admite uma solução analítica precisa.
Oscilador harmônico monodimensional[editar | editar código-fonte]
Hamiltoniano, energia e autofunções[editar | editar código-fonte]
No problema do oscilador harmônico monodimensional, uma partícula de massa está submetida a um potencial quadrático .
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
se denomina constante de força ou constante elástica, e depende da massa da partícula e da frequência angular .
O Hamiltoniano quântico da partícula é[1]:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde é o operador posição e é o operador momento .
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
O primeiro termo representa a energia cinética da partícula, enquanto que o segundo representa sua energia potencial. Com o fim de obter os estados estacionários (ou seja, as autofunções e os autovalores do Hamiltoniano ou valores dos níveis de energia permitidos), temos que resolver a equação de Schrödinger independente do tempo
- .
Pode-se resolver a equação diferencial na representação de coordenadas utilizando o método de desenvolver a solução em série de potências. Se obtém assim que a família de soluções é[2]
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde representa o número quântico vibracional. As primeiras seis soluções () se mostram na figura da direita. As funções são os polinômios de Hermite:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Não se devem confundir com o Hamiltoniano, que às vezes se denota por H (ainda que é preferível utilizar a notação para evitar confusões). Os níveis de energia são
- .
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Este espectro de energia destaca por três razões. A primeira é que as energias estão "quantizadas" e somente podem tomar valores discretos, em frações semi-inteiras , , , ... de . Este resultado é característico dos sistemas mecânico-quânticos[2].
A segunda é que a energia mais baixa não coincide com o mínimo do potencial (zero neste caso). Assim, a energia mais baixa possível é , e se denomina "energia do estado fundamental" ou energia do ponto zero.
A última razão é que os níveis de energia estão igualmente espaçados, ao contrário que no modelo de Bohr ou a partícula em uma caixa.
Convém destacar que a densidade de probabilidade do estado fundamental se concentra na origem. Ou seja, a partícula passa mais tempo no mínimo do potencial, como seria de esperar em um estado de pouca energia. A medida que a energia aumenta, a densidade de probabilidade se concentra nos "pontos de retorno clássicos", onde a energia dos estados coincide com a energia potencial. Este resultado é consistente com o do oscilador harmônico clássico, para o qual a partícula passa mais tempo (e portanto é onde seria mais provável encontrá-la) nos pontos de retorno. Se satisfaz assim o Princípio da correspondência.
Aplicação: moléculas diatômicas[editar | editar código-fonte]
Para estudar o movimento de vibração dos núcleos pode-se utilizar, em uma primeira aproximação, o modelo do oscilador harmônico. Se consideramos pequenas vibrações em torno do ponto de equilíbrio, podemos desenvolver o potencial eletrônico em série de potências. Assim, no caso de pequenas oscilações o termo que domina é o quadrático, ou seja, um potencial de tipo harmônico. Portanto, em moléculas diatômicas, a frequência fundamental de vibração será dada por[3]:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
que se relaciona com a frequência angular mediante e depende da massa reduzida da molécula diatômica.
Na física, uma partícula livre é uma partícula que, em certo sentido, não está vinculada por uma força externa, ou equivalentemente não está em uma região onde sua energia potencial varia. Na física clássica, isso significa que a partícula está presente em um espaço "sem campo". Na mecânica quântica, significa uma região de potencial uniforme, geralmente modulada para zero na região de interesse, uma vez que o potencial pode ser arbitrariamente arranjado para zero em qualquer ponto (ou superfície em três dimensões) no espaço.
Descrição matemática[editar | editar código-fonte]
Partícula livre clássica[editar | editar código-fonte]
A partícula livre clássica é caracterizada simplesmente por uma velocidade fixa v. O momento linear é dado por
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
e a energia cinética, que é igual à energia total, é dada por
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde m é a massa da partícula e v é o vetor velocidade da partícula.
Partícula livre quântica[editar | editar código-fonte]
Uma partícula livre na mecânica quântica (não relativística) é descrita pela equação de Schrödinger livre:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde ψ é a função de onda da partícula na posição r e tempo t. A solução para uma partícula com momento p ou vetor de onda k, na freqüência angular ω ou energia E, é dada pela onda plana complexa:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
com amplitude A. Como para todas as partículas quânticas livres ou ligadas, o princípio da incerteza de Heisenberg
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
(da mesma forma para as direções y e z) e as relações De Broglie:[1]:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
se aplicam. Como a energia potencial é adotada como zero, a energia t otal E é igual à energia cinética, que tem a mesma forma da física clássica:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Há várias equações que descrevem partículas relativísticas: veja equações de onda relativísticas
O pêndulo quântico é fundamental para entender as rotações internas impedidas na química, as características quânticas dos átomos de dispersão, bem como numerosos outros fenômenos quânticos.[1] Embora um pêndulo não sujeito à aproximação de pequeno ângulo tenha uma não-linearidade inerente, a equação de Schrödinger para o sistema quantizado pode ser resolvida de forma relativamente fácil.[2][3][4]
Equação de Schrödinger[editar | editar código-fonte]
Usando a teoria lagrangiana da mecânica clássica, pode-se desenvolver um hamiltoniano para o sistema. Um pêndulo simples tem uma coordenada generalizada (o deslocamento angular ) e duas restrições (o comprimento da corda e o plano de movimento). As energias cinéticas e potenciais do sistema podem ser encontradas em
Isso resulta no Hamiltoniano
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
A equação de Schrödinger dependente do tempo para o sistema é
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
É preciso resolver a equação de Schrödinger independente do tempo para encontrar os níveis de energia e os auto-estados correspondentes. Isso é efetuado melhor alterando a variável independente da seguinte maneira:
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Esta é a equação de Mathieu.[5]
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde as soluções são as funções Mathieu.
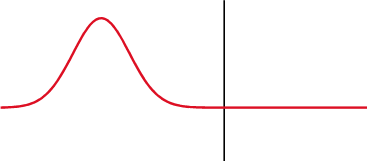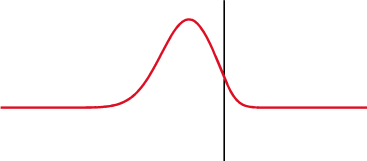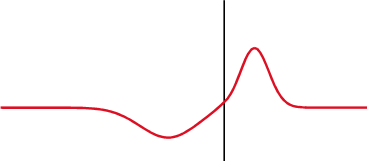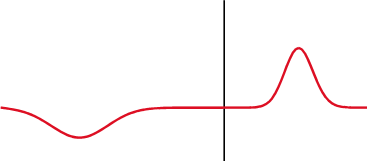
Na mecânica quântica, o potencial delta é um poço de potencial matematicamente descrito pela função delta de Dirac - uma função generalizada. Qualitativamente, corresponde a um potencial[nt 1] que é zero em todos os lugares, exceto em um único ponto, onde leva um valor infinito[2].
Potencial delta único[editar | editar código-fonte]
A equação de Schrödinger independente do tempo para a função de onda ψ(x) de uma partícula em uma dimensão em um potencial V(x) é
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde ħ é a constante reduzida de Planck e E é a energia da partícula.
O potencial delta é o potencial
- /
/ /
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde δ(x) é a função delta de Dirac.
É chamado um potencial de poço delta se λ é negativo e um potencial de barreira delta se λ é positivo. O delta foi definido para surgir na origem por simplicidade; uma mudança no argumento da função delta não altera nenhum dos resultados procedentes[3].

 =
=







 /
/  /
/ 






















![{\displaystyle H\psi \left(\mathbf {r} ,t\right)=\left(T+V\right)\,\psi \left(\mathbf {r} ,t\right)=\left[-{\frac {\hbar ^{2}}{2m}}\nabla ^{2}+V\left(\mathbf {r} \right)\right]\psi \left(\mathbf {r} ,t\right)=i\hbar {\frac {\partial \psi \left(\mathbf {r} ,t\right)}{\partial t}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c760d6d4a31533e9f8373d34b162648977d2e99)
![{\displaystyle \left[-{\frac {\hbar ^{2}}{2m}}\nabla ^{2}+V\left(\mathbf {r} \right)\right]\psi \left(\mathbf {r} \right)=E\psi \left(\mathbf {r} \right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e842606f156503d1e8114ef895bf49e9ac13062)
![\ J_{v}=K_{f}([P_{c}-P_{i}]-R[\pi _{c}-\pi _{i}])](https://wikimedia.org/api/rest_v1/media/math/render/svg/59bc7ebe23b4605b795b55ac9b523e0d1102658b)
![\ J_{v}=K_{f}([P_{c}-P_{i}]-[\pi _{c}-\pi _{i}])](https://wikimedia.org/api/rest_v1/media/math/render/svg/1637a60360bbce44b7593c972b0af717d35e01f5)




















































Comentários
Postar um comentário